6개 혁신신약 미국·유럽 등서 지정···총 19건
한미약품은 최근 EMA가 LAPSTriple Agonist를 원발 담즙성 담관염(PBC) 치료를 위한 희귀의약품으로 추가 지정했다고 10일 밝혔다.
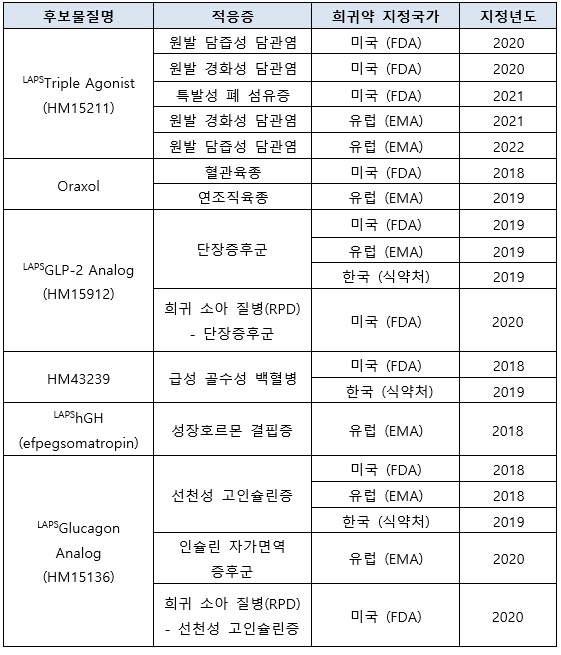
이로써 LAPSTriple Agonist는 미국 FDA로부터 3건, EMA로부터 2건 등 총 5건의 희귀의약품 지정을 받아, 국내 제약사가 개발한 신약 중 가장 많은 희귀의약품 지정 기록을 갖게 됐다. LAPSTriple Agonist는 FDA와 EMA로부터 각각 원발 담즙성 담관염과 원발 경화성 담관염 적응증으로 희귀약 지정을 받았으며, FDA로부터는 특발성 폐 섬유증 치료를 위한 희귀약 지정을 받은 바 있다.
이번 추가 지정에 따라 한미약품은 6개 파이프라인에서 10가지 적응증으로 총 19건(FDA 9건, EMA 7건, 한국 식약처 3건)의 희귀의약품 지정 기록을 보유하게 됐다. 이는 국내 제약사 중 가장 많은 기록이다.
FDA 및 EMA의 '희귀의약품 지정'은 희귀·난치성 질병 또는 생명을 위협하는 질병의 치료제 개발 및 허가가 원활히 이뤄질 수 있도록 지원하는 제도다. 유럽의 경우 허가신청 비용 감면, 동일계열 제품 중 처음으로 시판허가 승인 시 10년간 독점권 등 다양한 혜택이 부여된다.
자가면역성 질환인 원발 담즙성 담관염은 간내 담도의 원인 미상 염증 및 섬유화로 인해 발생ㅍ되는 만성 진행성 담즙 정체성 간질환이다. 담관이 점진적으로 파괴돼 담관 폐쇄 및 간조직 손상을 유발하며, 심할 경우 간 이식이 필요한 상황에 이르기도 한다.
LAPSTriple Agonist는 GLP-1 수용체, 글루카곤 수용체 및 GIP 수용체의 동시 활성화 작용을 하는 삼중작용제로, 다중 약리학적 효과를 바탕으로 과도한 간 담즙산 축적을 감소시키고 간 염증 및 섬유증을 억제해 각종 자가면역간질환 환자들의 삶의 질을 획기적으로 개선할 수 있을 것으로 기대된다.
한미약품 권세창 사장은 "삼중작용 바이오신약 LAPSTriple Agonist가 다양한 적응증에서 의미 있는 잠재력을 지속적으로 확보해 나가고 있다"며 "희귀질환으로 고통받는 환자들의 삶의 질 향상을 위해 LAPSTriple Agonist 개발과 상용화에 최선을 다하겠다"고 말했다.

뉴스웨이 유수인 기자
suin@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지






댓글