동아쏘시오홀딩스에서 독립···2015년 홀로서기 나서M&A전문가 박동현 대표 최대주주 8.03% 보유‘유데나필’ 신약 후보물질 근간으로 신약개발 노력폰탄수술환자 치료제, 빠르면 내년 2분기 FDA 승인
메지온은 2002년 동아쏘시오홀딩스(옛 동아제약)에서 연구개발 조직이 분리 독립돼 동아팜텍이란 사명으로 설립됐다. 이후 2013년 메지온으로 사명을 변경했으며 2015년 5월 동아쏘시오홀딩스가 메지온 지분 10.87%(88만3818주)를 장내매도하면서 13년 만에 홀로서기에 나서게 됐다.
현재 메지온 최대주주이인 박동현 대표는 2015년 동아쏘시오홀딩스가 메지온 지분을 정리하며 관계를 청산한 이후 꾸준히 메지온 지분을 사들여 회사 지배력을 키워나갔다.
22일 현재 메지온 최대주주는 박동현 외 2인으로 22.56%를 보유 중이다. 박동현 대표가 8.03%를 갖고 있으며 부인인 김혜수씨가 3.31%, 특수관계인으로 묶인 CCE Investment 지분은 11.22%이다.
KB자산운용도 1분기 분기보고서 기준 3.89%를 보유 중이다. KB자산운용은 지난해 10%가 넘는 지분을 보유 중이었으나 주가가 상승하자 차익실현에 나서며 보유지분을 꾸준히 줄여나갔다.
박동현 대표는 한인 1세대 금융전문가로 예일대를 졸업해 메릴린치에 입사하는 등 M&A전문가로 활동한 바 있다. 1999년부터는 동아제약의 사외이사로 활동했다. 동아제약이 2002년 주력 계열사였던 메지온 지분을 매각할 때 최대주주로 올라섰다.
메지온은 유데나필이라는 신약 후보물질을 근간으로 발기부전치료제를 포함해 다양한 적응증에 대한 글로벌 신약개발을 목표로 수년간 노력해오고 있다.
미국, 캐나다, 멕시코, 러시아 지역에서 유데나필에 대한 물질특허권을 보유하고 있으며 유데나필을 이용해 미국에서 신약이 폰탄수술환자 치료제, 폐동맥고혈압치료제 등을 개발 중이다.
메지온은 최근 선천성 심장기형 중 하나인 단심실(SVHD) 환자들의 폰탄수술(우심방-폐동맥 우회술) 이후 합병증 예방을 위한 희귀치료제를 개발로 주목받고 있다.
폰탄수술은 심장구조상 정상적으로 2개가 있어야 하는 심실이 한 개만 또는 한쪽 심실이 매우 작은 선천성 심장기형 3세이하 어린이에게 최대한 정상적인 심장기능을 수행할 수 있도록 시술하는 3단계의 심장수술 중 마지막 단계의 수술을 의미한다.
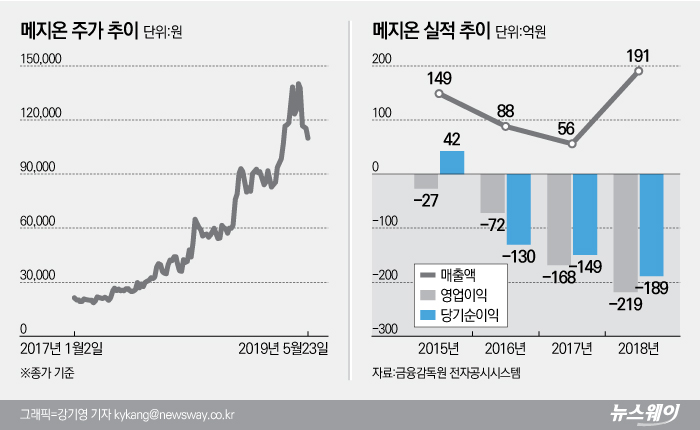
신약개발에 대한 기대감이 커지며 지난해부터 주가도 급등세를 보이기 시작했다.
작년 연초 4만2650원이던 주가는 연말 9만2000원으로 115.71%의 상승률을 보였으며 올해도 연초 8만9800원에서 23일 종가기준 10만9700원으로 22.16% 뛴 상태다.
올해 4월 18일 15만1400원으로 사상 최고가를 찍기도 했으나 이후 다시 하락세를 보이며 주춤하는 모습을 보이고 있다.
최근 주춤한 주가는 유데나필의 폰탄수술을 시행한 단심실환자 대상 유산소 운동능력 임상3 상의 결과발표가 지연된 영향도 미친 것으로 분석된다.
메지온의 유데나필 임상 3상은 폰탄수술을 시행한 12~18세 단심실환자 400명을 대상으로 작년 6월부터 12월까지 26주간 진행됐다.
이 데이터는 4월 중순경 공개될 것으로 기대됐으나 병원간 데이터 편차의 보완 문제로 인해 지연되고 있다.
임상을 진행한 CRO업체 NERI는 임상 사이트에서 측정방법 및 입력 등의 문제로 데이터 편차와 오류가 발생한 것을 발견했고 확실한 데이터 확보를 위해 약 2달간 전수조사를 통해 보완 후 6월말~7월초 임상 3상 탑 라인(Top Line) 데이터를 발표할 예정이다.
메지온 관계자는 “단심실환자 대상 임상3상 결과 발표가 2개월가량 지연된 것은 사실이나 일정상 크게 변동되는 것은 없을 것”이라며 “오는 30일 주주 대상 IR행사를 열고 이 같은 부분에 대해 설명할 예정”이라고 밝혔다.
금융투자업계에서도 임상 3상 데이터 발표가 지연됐어도 승인 관련 일정은 크게 변하지 않을 것으로 보고 있다.
메지온은 지난 2일 FDA와 Type B Meeting을 진행했다. 이는 판매허가 신청 전 Pre-NDA부터 임상 3상까지의 내용, 마케팅 및 시판 후 요구사항까지 논의하는 자리다.
신재훈 한화투자증권 연구원은 “유데나필의 NDA(신약허가신청)은 올해 3분기로 예정돼 있으며 우선심사(Priority Review) 적용시 빠르면 내년 2분기에도 허가가 가능할 것으로 보인다”고 말했다.
미국 FDA는 희귀소아질환치료제나 풍토병 등의 개발 유도를 위해 우선심사를 개발사에 부여하고 있으며 우선심사권으로 신약허가 신청시 개발사가 같이 제출하면 허가기간을 6개월로 단축한다. 정상 심사기간은 10개월이다.
신 연구원은 “메지온의 기업가치는 임상 3상 성공 및 FDA 승인 획득에 따라 순차적으로 증가할 예정이며 연간치료 비용이 정해짐에 따라 변동이 있을 것”이라고 밝혔다.
관련기사
관련태그

뉴스웨이 이지숙 기자
jisuk618@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지








댓글