연구용키트, 진단목적으로 오용 가능성 미국서 무허가 제품 유통돼 경고 조치 사측 "선제적 리콜···제품엔 문제 없다"
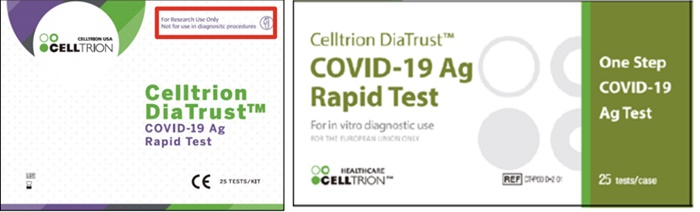
셀트리온 미국법인(Celltrion USA)은 14일(현지시각) 진단 목적으로 오용될 가능성이 있는 연구용 코로나19 진단키트 'DiaTrust COVID-19 Ag Rapid Test Kit'를 자발적으로 리콜한다고 밝혔다.
리콜 대상은 제조단위(로트) COVGCCF0001과 COVGCCF0002 2종으로, 각각 6월7일과 6월9일 사용기한이 만료된다. 키트에는 각각 25개의 개별 진단도구가 포함됐다. 회사에 따르면, 2020년 12월18일부터 10만4200개의 도구가 포함된 4168개의 진단키트가 출하된 상황이다.
앞서 이달 초에는 미국에서 정식으로 허가된 제품과 다른 포장을 사용한 'DiaTrust COVID-19 Ag Rapid Test Kit'에 대해 미국 식품의약국(FDA)으로부터 경고를 받았다. 미국에서 승인‧허가 받지 않은 상태에서 유통됐다는 이유에서다. FDA는 허가되지 않은 제품을 사용할 경우 부정확한 결과가 나올 수 있다며 지난 2주 이내에 이들 제품으로 검사를 했다면 다시 검사를 받아야 한다고 지적했다. 이에 회사는 해당 제품에 대한 리콜을 개시했다.
잇따른 리콜 조치로 제품 안전성에 대한 의혹까지 제기되고 있는 가운데 셀트리온은 "현지 유통과정에서 발생한 절차적인 이슈"였다고 일축했다.
우선 연구용 진단키트의 경우 비전문가가 사용할 우려가 있어 예방적 차원에서 자발적으로 리콜 조치했다는 입장이다. 해당 제품은 숙련된 실험자가 연구용(RUO)으로 사용되도록 만들어져 '연구 전용'으로 라벨링돼 있지만 실제 목적과 달리 진단 목적으로 사용됐을 수 있다는 것이다.
셀트리온 미국법인은 "연구환경이 아닌 상황에서 이 진단키트를 사용하면 코피 등 물리적 위해가 발생할 수 있고 잘못된 테스트 결과도 나올 수 있다"며 "특히 잘못된 테스트는 확진자의 진단 및 치료를 지연시킬 수 있으며 질병 확산에 영향을 미칠 수 있다"고 전했다.
셀트리온 관계자는 "제품에 문제가 있는 것은 아니"라며 "FDA는 목적에 따라 제품 구분을 철저히 한다. 해당 제품은 연구용인데 소비자들이 진단용으로 잘못 쓸 수 있어서 선제적으로 회수한 거다. 회수 절차는 거의 끝나간다"고 부연했다.
FDA의 경고를 받은 제품에 대해서는 유럽 시장용으로 허가받은 제품이 미국에서 유통된 것이라고 이 관계자는 설명했다.
그는 "해당 제품은 유럽에서 허가받은 제품인데 물건을 떼어 파는 유통업체에서 진단키트를 쉽게 생각하고 절차 없이 미국에서 유통시킨 것 같다"며 "제품상 문제가 아닌 현지 유통과정에서 발생하는 절차적인 이슈로 보면 될 것 같다. 지금 회수도 거의 끝나서 추가로 유통될 리스크는 없다"고 말했다.

뉴스웨이 유수인 기자
suin@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지







댓글