
제약·바이오
의료·제약업계, 인력·동물실험 줄이고, AI·대체시험 늘리고
미국 FDA가 인력 구조조정과 함께 인공지능(AI) 도입, 동물실험 축소 및 대체시험 확대 정책을 본격 추진하면서 글로벌 제약바이오 시장에 지각변동이 일고 있다. 국내외 기업들은 AI 자동화와 오가노이드 등 신기술 도입을 가속화하며 연구개발(R&D) 효율성과 비용 절감에 주력하고 있다.
[총 64건 검색]
상세검색

제약·바이오
의료·제약업계, 인력·동물실험 줄이고, AI·대체시험 늘리고
미국 FDA가 인력 구조조정과 함께 인공지능(AI) 도입, 동물실험 축소 및 대체시험 확대 정책을 본격 추진하면서 글로벌 제약바이오 시장에 지각변동이 일고 있다. 국내외 기업들은 AI 자동화와 오가노이드 등 신기술 도입을 가속화하며 연구개발(R&D) 효율성과 비용 절감에 주력하고 있다.

제약·바이오
HLB 진양곤 회장 "5월 재허가 신청, 7월 최종 승인 도전"
HLB는 FDA가 표적항암제 '리보세라닙'에 대해 또다시 보완요청서(CRL)를 발급하자 당황했고, 캄렐리주맙 제조품질관리(CMC) 문제 해결을 위해 5월 재허가를 신청할 계획이다. 사측은 항서제약과 협력해 미비점을 파악하고 대응할 예정이며, 7월 유럽 허가 신청 등 타 계획은 차질 없이 진행될 전망이다.
제약·바이오
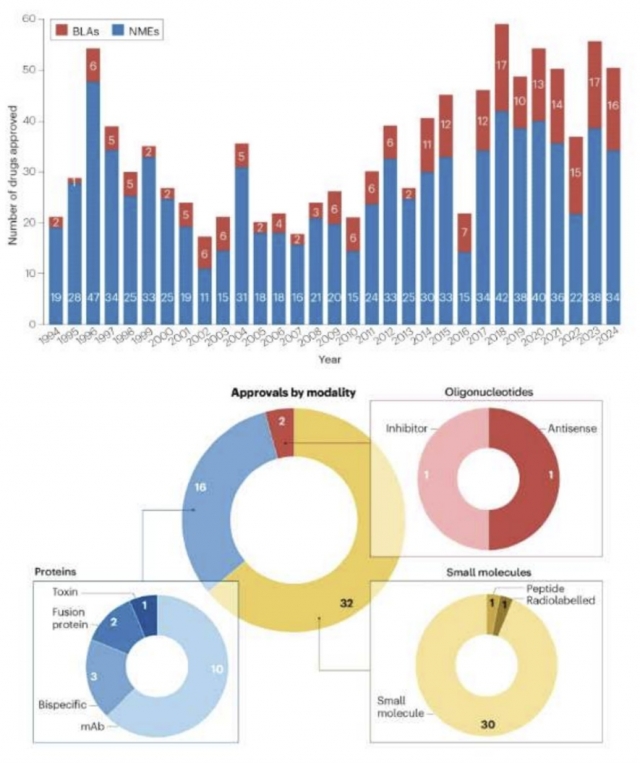
美 FDA 허가 신약 30%는 '항암제'···'MASH·조현병' 치료제도 나와
지난해 미국 식품의약국(FDA) 허가를 받은 신약은 총 50개에 달하는 것으로 집계됐다. 여기에는 국내 제약바이오 기업 제품 2종이 포함됐고, 그동안 치료제가 없었던 분야에서도 신약이 나왔다. 4일 국제학술지 네이처 리뷰 드럭 디스커버리와 한국바이오협회에 따르면, 지난 한 해 미국 FDA 의약품평가연구센터(CDER)는 저분자신약, 생물학적 제제 및 올리고뉴클레오타이드 등 총 50개 신약을 허가했다. 지난 30년(1994년~2023년)간 두 번째로 많이

제약·바이오
[NW리포트]올해 FDA 희귀의약품 지정 국내약 21개···K바이오 블루오션 개척
올해 미국 FDA 희귀의약품 지정(ODD) 품목 리스트에 기재된 국내 제약바이오 의약품은 21개다. 작년 FDA ODD 국내 제약품 16개 보다 5개가 늘었다. 17일 기준 FDA ODD 463개 중 미국 290개, 중국 66개 이어 3위를 차지하고 있다. FDA ODD는 미국에서 통상 환자 수가 10만 명 이하인 질병에 대한 치료제에 대해 신속심사, 감세, 7년간 시장독점권 지위 등 다양한 혜택을 제공한다. FDA ODD는 바이오벤처 기업 타겟이었다. 하지만 최근

유통일반
콜마비앤에이치, 美 FDA로부터 '무결점 NAI' 등급 획득
콜마비앤에이치는 세종공장과 음성공장에 대한 현장 실사에서 미국 FDA(식품의약국)로부터 '무결점 NAI(No Action Indicated)' 등급을 획득했다고 23일 밝혔다. 세종공장과 음성공장은 미국 수출품목 제조시설이다. 콜마비앤에이치는 이번 성과로 미국 FDA의 cGMP(식품에 대한 우수제조관리기준)를 충족하며 글로벌 건강기능식품 제조자개발생산(ODM) 기업으로서의 경쟁력을 한층 강화하게 됐다는 평가다. 이번 미국 FDA의 실사에서 무

제약·바이오
대세는 '규제 완화'···저무는 '인터체인저블' 시대
미국 식품의약국(FDA) 관계자가 '인터체인저블'(interchangeable, 상호교환성) 바이오시밀러 제도 폐지를 시사했다. 글로벌 의약품 규제 완화 바람이 불며 국내 제약바이오 기업에도 유리한 환경이 조성되고 있다. 지난 5일 '2024 글로벌 바이오 콘퍼런스'(GBC)에서 '유전자재조합의약품 포럼'이 진행됐다. GBC는 식품의약품안전처(식약처)가 주최하는 행사로 6일까지 서울 강남구 그랜드 인터컨티넨탈 파르나스에서 진행된다. 이번 포럼은 유전자재조

기자수첩
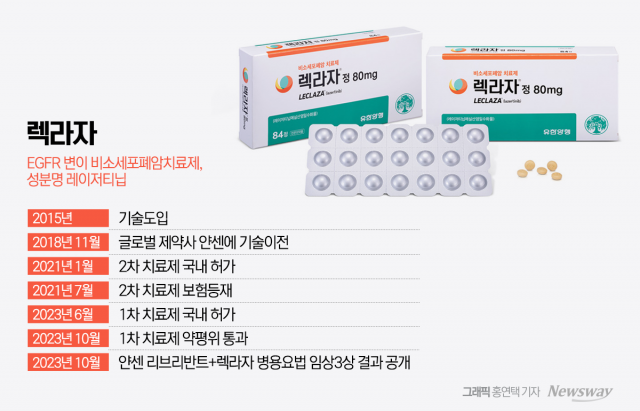
[기자수첩]'렉라자' 美 진출, '자력 진출' 블록버스터 첫걸음 되길
유한양행의 비소세포폐암 신약 '렉라자'(성분명 레이저티닙)가 국산 항암제로는 최초로 미국 식품의약국(FDA) 품목허가를 받았다. 지난 2021년 제31호 국산 신약으로 허가받은 지 3년 만이다. 관련 협회까지 나서서 환영 성명서를 발표할 만큼 국내 제약바이오 업계는 들뜬 분위기다. 기존에 이미 렉라자의 FDA 승인 가능성을 높게 보고 있던 관련 업계에서는 이제 렉라자의 글로벌 블록버스터 진입에 대한 기대감을 키우고 있다. 블록버스터란 연 매

제약·바이오
국가신약개발사업단 "'렉라자' 美 FDA 승인···국가신약개발사업 결실"
국가신약개발사업단은 국산 항암제 '렉라자'가 미국 식품의약국(FDA)에 시판 허가를 받으며 글로벌 제약 시장에 새로운 지평을 열었다는 내용의 논평을 지난 21일 발표했다. 국가신약개발사업단은 유한양행 '렉라자'(미국 상품명 LAZCLUZE)가 미국 FDA에 1차 치료제로 승인받았다고 지난 20일 밝혔다. 이는 EGFR 엑손 19 결실 또는 엑손 21(L858R) 치환 변이가 확인된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인 환자들을 대

제약·바이오
FDA 문턱 넘은 유한양행 '렉라자'···국산 블록버스터 기대감 '솔솔'
유한양행의 폐암 치료제 '렉라자'(성분명: 레이저티닙)가 미국 식품의약국(FDA) 품목 허가를 받았다. 국산 항암제가 글로벌 제약사로 기술 이전돼 승인까지 이어진 첫 사례다. 21일 제약바이오 업계에 따르면 존슨앤드존슨(J&J)은 이날 FDA가 렉라자·리브리반트 병용요법을 국소 진행성·전이성 비소세포폐암(NSCLC) 환자 대상 1차 치료제로 승인했다고 밝혔다. '리브리반트(성분명 아미반타맙)'는 존슨앤드존슨 자회사 얀센의 정맥주사(IV
제약·바이오
유한양행 '렉라자', 국산 항암제 최초 FDA 허가 승인
유한양행의 비소세포폐암 치료제 '렉라자'가 세계 최대 의약품 시장인 미국에서 시판허가를 받았다. 국내 제약사가 항암 분야에서 글로벌 제약사에 기술수출해 미국 식품의약국(FDA) 승인을 받은 것은 이번이 처음이다. 유한양행은 렉라자와 존슨앤드존슨(J&J)의 리브리반트(성분명 아미반타맙)가 상피세포성장인자수용체(EGFR) 엑손 19 결실 또는 엑손 21 L858R 치환 변이가 확인된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인 환
+ 새로운 글 더보기