고려대의대 연구팀, 신약재창출 R&D 사례 공개'독사조신' 삼중음성유방암 치료옵션으로 잠재력 확인 c-MET·EGFR 등 억제, 타그리소보다 결합 친화도 ↑

김지영 고려대 의과대학 연구교수는 지난 10일 고려대 구로병원에서 열린 R&D 페어에서 유방암 타깃의 신약재창출 연구사례를 공개하고 "신약재창출 방식은 경제적이면서 안전성을 확보할 수 있는 방법이다. 동시에 미충족 의료수요 충족을 기대할 수 있다"고 강조했다.
<span class="middle-title">신약재창출, 후보물질 발굴·독성시험 기간 단축···개발 가능성 ↑
신약재창출은 이미 시판중이거나 임상단계에서 안전성 이외의 이유로 상용화에 실패한 약물들을 다른 의학적 용도를 개발하는 신약개발의 한 방법이다. 대표적으로 협심증 치료제로 개발됐다가 발기부전 치료 효과가 확인된 비아그라(성분명 실데나필), 궤양 및 고혈압 치료제로 개발되던 탈모 치료제 '미녹시딜' 등이 있다.
신약재창출 방식은 신약 후보물질 탐색 및 발굴이 필요 없어 시간과 비용을 크게 절약할 수 있고 약물 약동학 등 안전성과 관련된 위험성도 낮출 수 있다는 장점이 있다. 김 교수는 "통상 5000~1만개의 신약후보물질에서 1개의 신약이 개발된다. 후보물질 개발부터 시판까지 10년 이상 걸리고 비용도 1조6000억원 정도 발생한다"며 "하지만 임상 1상 또는 2상에 진입하더라도 약물의 효능 부족, 안전성 문제 등으로 80%는 실패한다"고 했다.
그는 "이미 상용화된 약물을 이용한 신약재창출 방식은 안전성이 검증된 약물을 대상으로 하기에 독성 검사 기간을 단축시킬 수 있다. 유효성이 입증되면 바로 임상 진입이 가능하다"고 부연했다.
<span class="middle-title">고대의대, 전립선비대증 약물로 TNBC 치료 가능성 확인
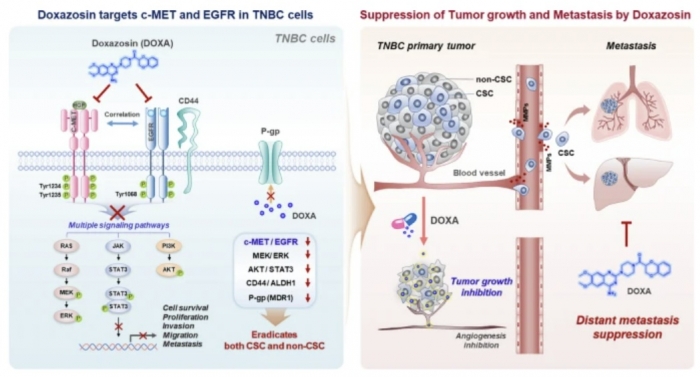
특히 암줄기세포가 폐와 간 전이를 촉진하는 것으로 알려져 암줄기세포 및 암세포 동시 억제 약물 개발이 필요한 상황이다.
연구팀은 HER2 양성 약물내성 및 TNBC 전이 관련 미국 식품의약국(FDA) 승인 약물 라이브러리 스크리닝을 통해 각각 1500종의 약물을 도출하고, 2차 스크리닝을 통해 200종을 선별, 이후 데이터베이스 분석으로 32종 선별 후 최종적으로 8개 약물을 선정했다.
김 교수는 "기존 신약재창출 임상사례들을 보면, 특정 약물의 효과가 좋다고 하면 그 약물에만 우르르 몰리곤 했다. 우리도 마찬가지였다"면서 "이번에는 직접 암줄기세포를 표적하는 약물을 찾아봤다"고 말했다.
김 교수는 임상 과정에서 고혈압 및 전립선비대증 치료제인 '독사조신'을 TNBC 치료제로 개발할 수 있는 가능성을 확인했다고 밝혔다. 해당 연구결과는 지난 4일 국제학술지 '실험 및 임상 암 연구 저널(Journal of Experimental & Clinical Cancer Research)에 게재됐다.
독사조신은 퀴나졸린 기반 알파 1-아드레날린 수용체(A1AR) 길항제다. 연구에 따르면, 독사조신은 카스파제(세포사멸에 필수적 역할을 하는 단백질 분해 효소) 활성화를 통해 세포사멸을 유도함으로써 TNBC 세포에 대해 주목할 만한 항증식 효과를 나타낸 것으로 확인됐다.
<span class="middle-title">c-MET·EGFR 억제도 확인···개발 성공시 차세대 약물보다 비용 부담 낮출 수 있어
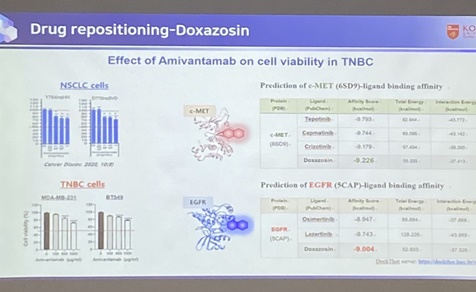
c-MET와 EGFR 유전자는 새 암세포의 성장과 증식에 필수적인 수용체로, TNBC에서 동시 과발현할 경우 예후가 좋지 않다. 환자의 40% 이상에서 과발현되는 것으로 알려진다. 연구팀은 CD44(암 줄기세포 유전자) 발현도 환자 예후에 악영향을 끼친다는 점을 확인, EGFR·CD44 억제가 TNBC 전이 예방의 치료 전략으로 활용될 수 있다고 봤다.
분자 도킹 연구 결과 c-MET 억제제인 크리조티닙(상품명 잴코리)·캡마티닙(타브렉타)·데포티닙(텝메코) 및 c-MET(6SD9)의 예측된 결합 친화도 값은 각각 -9.179, -9.744, -9.793(kcal/mol)이었다. 독사조신은 -9.226kcal/mol로, 크리조티닙보다 c-MET의 예상 결합 친화력이 높았다.
또 독사조신은 EGFR을 표적으로 삼고 P-당단백질을 하향 조절하는 것으로 나타났다.
EGFR 관련 분자 도킹 연구에서 독사조신의 예측 결합 친화력과 상호 작용 에너지는 각각 -9.004kcal/mol, -37.328kcal/mol였다. 반면 3세대 EGFR 표적항암제 오시머티닙(타그리소)과 레이저티닙(렉라자)의 결합 친화도 값은 각각 -8.947 및 -9.743 kcal/mol로 나타나 독사조신과 EGFR의 결합 친화력이 오시머티닙의 결합 친화도보다 높은 것으로 확인됐다.
이와 함께 연구팀은 독사조신이 CD44-EGFR 축을 방해해 암줄기세포(CSC)와 유사한 특성을 손상시킬 가능성도 확인했다.
연구팀은 논문에서 "TNBC에서 c-MET와 EGFR의 동시 과발현은 약물 내성 및 불리한 임상 결과와 밀접한 상관관계가 있다"며 "c-MET와 EGFR의 이중 억제는 현재 비소세포폐암 치료를 위해 3상 시험을 진행하고 있는 얀센의 아미반타맙(리브리반트) 개발과 함께 점점 더 많은 주목을 받고 있다. 하지만 차세대 c-MET 및 EGFR 억제제는 높은 비용으로 전 세계 환자들의 접근성이 제한된다"고 했다.
그러며 "독사조신의 항종양 및 항전이 효과를 확인한 이번 임상 결과는 TNBC 환자, 특히 사회경제적 계층이 낮은 환자의 전체 생존율을 향상시키기 위한 실행 가능한 전략을 나타낸다는 점에서 의미가 있다"며 "약물 용도 변경은 제조, 약동학 및 안전성 매개변수와 관련된 임상 개발 위험이 거의 없다"고 의의를 밝혔다.
이어 "TNBC 치료에서 독사조신의 임상적 적용에 대한 추가 조사가 필요하다"고 전했다.

뉴스웨이 유수인 기자
suin@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지







댓글