173개사 작년 R&D 4조원···전년비 47% 증가다국가 임상 비중 47.7%아시아 임상 허브 부상
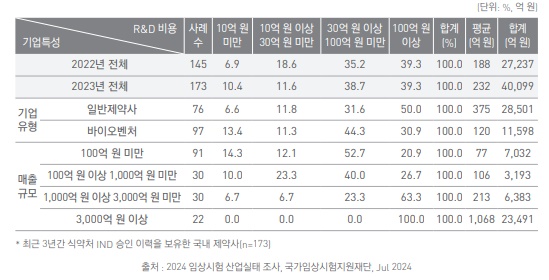
4일 국가임상시험지원재단(이하 재단)이 발간한 한국임상시험백서에 따르면, 최근 3년간 식품의약품안전처 임상시험계획(IND) 승인을 받은 국내 제약사 173개사가 지난해 사용한 연구개발 비용은 약 4조99억원으로 추정된다. 이는 전년 2조7237억원 보다 약 47% 증가한 수치다.
매출 규모 3000억원 이상의 제약사들은 모두 100억원 이상의 R&D 비용을 지출한 것으로 확인됐다.
이 중 임상시험에 투자한 비용을 조사한 결과, 응답 기업 90개사 기준 총 6164억원으로 나타났다. 90개사 전체 R&D 비용(2조1051억원)의 약 29.3% 수준이었다. 전년(5046억원)과 비교해서는 약 22% 증가했다.
특히 지속된 경제적 불확실성에도 불구하고 상위 30개 기업 중 7개 기업은 2022년, 2023년 모두 1000억원 이상의 금액을 R&D에 투자하는 등 신약개발 경쟁력 강화 노력을 이어갔다.
특히 지난 2019~2023년 IND 승인을 받은 임상시험 중 한국을 포함, 2개국 이상에서 실시하는 다국가 임상시험 비중은 47.7%(1837건)으로 나타났다. 이는 직전 5년(2014~2018년)보다 4.2%p 증가한 수치다.
우리나라에서만 진행된 단일국가 임상시험은 같은 기간 56.5%에서 52.3%로 감소했는데, 이는 다국가 임상시험 비중이 증가했기 때문으로 분석된다.
국내에 진출한 글로벌 제약사들 또한 지속적으로 연구개발 투자 규모를 늘리고 있다. 국내 진출 글로벌 제약사의 최근 5년(2018~2022년)간 R&D 투자 비용은 연평균 14.8%씩 증가했다. 이는 국내에 진출한 글로벌 제약사들이 한국 시장에서의 연구개발 활동을 적극적으로 확대하고 있음을 나타낸다.
글로벌 제약사가 진행한 임상 연구 건수는 지난 2022년 기준 총 1600건이었다. 특히 임상1상과 임상2상의 초기 임상시험의 연평균 증가율이 각각 14.5%와 9.4%로 높았으며, 임상개발 초기 단계부터 한국을 포함해 진행하는 비중이 높아진 것으로 확인됐다.
이에 국내 임상시험 경쟁력도 높아지고 있다.
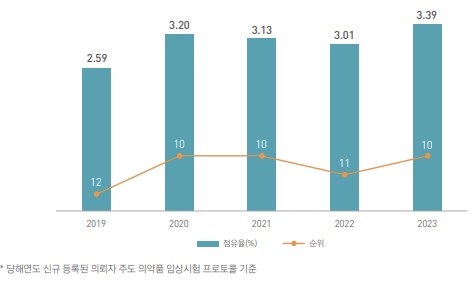
전 세계 의뢰자 주도 약물 중재 임상시험에서 한국의 국가별 점유율 순위는 2019년 8위에서 지난해 4위로 올라섰다.
한국의 글로벌 경쟁력을 확인할 수 있는 다국가 임상시험에 초점을 맞추어 살펴보면, 2019년까지 3% 미만을 유지하던 점유율은 2020년 처음으로 이 수치를 넘어서며 10위권 진입에 성공했다. 작년 기준 한국의 제약시장 점유율(2.6%)이 전 세계 13위인 점을 감안할 때 시장 규모에 비해 임상시험 경쟁력이 상대적으로 높은 수준에 있음을 시사한다.
또 다국가 임상시험 점유율 상위 10위에 속하는 국가들 중 한국이 유일한 아시아 국가라는 점도 위상을 확인할 수 있는 부분이다. 임상 단계별로 보면 임상1상 단계에서 한국이 차지하는 비중은 7위로 2019년 대비 3배 가까이 증가했다. 임상2상은 10위, 임상3상은 11위였다.
도시별로 봐도 서울이 지난 7년간 점유율 1위를 기록하며 독보적인 지위를 차지하고 있다. 글로벌 수준의 임상시험실시기관(의료기관), 우수 인력 등이 서울에 집중 분포된 것이 강점으로 작용했다. 빠르고 효율적인 임상시험 수행이 가능하기 때문이다.
재단은 한국이 아시아 임상시험 허브 중 하나로 떠오르고 있다고 진단하며 다국가 임상시험 유치를 위한 전략들을 제시했다.
우선 신흥 기업들을 중심으로 한국의 임상 역량을 알릴 필요가 있다고 강조했다. 재단은 "최근 신규 임상시험 의뢰자 3분의 2는 대형 글로벌 제약사가 아닌 중국, 미국, 유럽 등을 기반으로 하는 신흥 바이오제약사(EBP)인 만큼 이들을 대상으로 한국의 임상시험 역량 홍보를 강화해야 한다"고 주장했다.
또 미국 식품의약국(FDA)의 다양성 계획(Diversity Plan)에 대비할 필요가 있다고 했다.
현재 FDA는 미국 내 흑인, 히스패닉, 라틴계 등 소수인종의 임상시험 참여가 미국 인구 통계 평균에 미치지 못하는 점을 지적하고 있다. 이에 임상시험 후기 단계 승인을 원하는 연구자와 기업에게 시험 참가자 간 다양성을 보장하기 위한 계획을 제출하도록 곧 요구할 예정이다.
이런 가운데 중국의 임상시험 승인 기간이 빨라지면서 다국가 임상시험에 등록되는 중국 환자 수가 증가하고 있다. 이는 FDA 다양성 계획의 요건을 맞추기 위해 임상시험에 참여하는 아시아계 환자들의 비중 제한으로 이어지는 실정이다.
재단은 "미국의 규제 변화 및 다른 국가들의 임상시험 지원 정책들이 한국의 글로벌 임상시험 참여에 미치는 부정적 영향과 대처 방안 마련에 대한 관심과 논의가 필요하다"고 했다.
그러며 "이를 테면 고도의 임상시험 수행 역량을 가진 소수의 국가 및 기관에서 독점하고 있는 1상, 2상 임상시험을 더욱 적극적으로 유치하는 것을 전략으로 삼을 수 있다"면서 "한국의 우수한 인력과 인프라를 적극 홍보하고 정책적으로 초기 개발 단계에 대한 빠른 승인이 가능하도록 규제의 유연성을 높여 나갈 필요성이 있을 것"이라고 부연했다.
이와 함께 재단은 규제당국이 혁신적인 접근법에 대해 유연성을 높일 필요가 있다고 제언했으며, 연구자 주도 임상시험, 비수도권 임상시험 등 지원이 필요한 부분도 있다고 강조했다.
특히 연구자 주도 임상시험은 재원을 담당하는 공공 주체가 없고, 규제를 담당하는 주체도 없어 여러 가지 법령과 규정에 따른 규제가 혼란스러운 상황이라고 지적했다.
실제 미국은 최근 5년간 전체 임상시험의 40% 정도가 연구자 주도 임상시험인데 반해 국내는 20% 미만으로 나타난다.
재단은 "인적자본, 재정 지원, 연구 참여자, 정보 시스템, 기관 협력 등을 체계적으로 구성하고 관리하는 제도적인 지원이 보완이 필요하다"고 말했다.
임상시험의 지역적 편차가 심한 점도 한계로 지적된다. 현재 서울을 중심으로 의료기관이 밀집돼 있어 주요 대학병원에 임상시험이 집중돼 있는데, 지역 간의 불균형으로 인해 지방 환자들의 임상시험의 참여 기회가 제한되는 점이 단점으로 꼽힌다.
재단은 "비수도권 지역 임상시험 활성화를 위한 제도적·재정적 지원이 있어야 한다. 이를 통해 한국의 임상시험 점유율을 높일 수 있는 요소들을 찾아야 한다"고 강조했다.
관련태그

뉴스웨이 유수인 기자
suin@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지







댓글