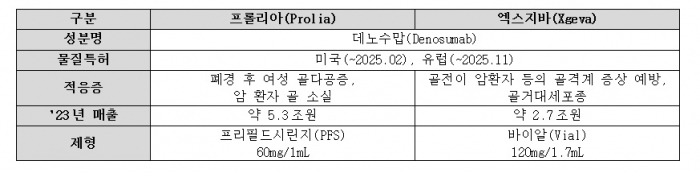
프롤리아와 엑스지바는 암젠(Amgen)이 개발한 바이오 의약품이다. 주성분인 데노수맙의 용량과 투약 주기를 달리해 골다공증 치료제 프롤리아와 골전이 환자 등의 골격계 증상(SRE) 예방 및 골거대세포종 치료제 엑스지바 두 제품으로 승인 받았다. 지난해 두 제품의 연간 합산 글로벌 매출 규모는 약 8조원에 달한다.
삼성바이오에피스는 오리지널 의약품과 동일하게 적응증 별로 프롤리아 바이오시밀러 '오보덴스'와 엑스지바 바이오시밀러 '엑스브릭'의 두 제품으로 각각 유럽에서 허가 권고를 받았으며, 통상 2~3개월 가량 소요되는 유럽 집행위원회(EC)의 최종 검토를 거쳐 공식 판매 허가를 얻을 수 있을 것으로 예상된다.
삼성바이오에피스는 현재 유럽 시장에서 총 8종의 바이오시밀러 제품을 출시했으며, 지난 9월 허가 권고를 받은 안과 질환 치료제 아일리아의 바이오시밀러 '오퓨비즈'(성분명 애플리버셉트)에 이어 오보덴스·엑스브릭 또한 공식 승인을 받으면 유럽에서 총 11종의 바이오시밀러 제품을 확보하게 된다.
삼성바이오에피스 RA(Regulatory Affairs)팀장 정병인 상무는 "금번 유럽 허가 권고를 통해 당사가 보유한 글로벌 수준의 R&D 역량을 재차 입증했으며, 다양한 제품 포트폴리오를 통해 더 많은 환자에게 바이오시밀러를 활용한 치료 기회를 제공할 수 있도록 지속 노력해 나가겠다"고 전했다.
한편, 삼성바이오에피스는 2020년 11월부터 2022년 12월까지 한국을 포함한 5개국에서 폐경 후 골다공증 환자 457명을 대상으로 SB16(오보덴스·엑스브릭의 프로젝트명)과 오리지널 의약품 간 효능 및 안전성을 비교하는 글로벌 임상 3상을 진행했다.
이어 지난해 10월 미국 골대사 학회(ASBMR) 연례 학술대회를 통해 임상 1·3상 데이터를 공개함으로써 SB16과 오리지널 의약품 간 임상의학적 동등성을 입증한 바 있다.

뉴스웨이 유수인 기자
suin@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지




















댓글