전환사채 CB 만기·풋옵션 리스크 급부상허가 지연 시 부채 부담 가중될 듯항서제약 제조시설 이슈, 시장 신뢰 시험대
OpenAI의 기술을 활용해 기사를 한 입 크기로 간결하게 요약합니다.
전체 기사를 읽지 않아도 요약만으로 핵심 내용을 쉽게 파악할 수 있습니다.
HLB, 간암 치료 신약 FDA 품목허가 세 번째 도전 본격화
FDA 승인 실패 시 주가 하락, 전환사채 조기상환 리스크 우려
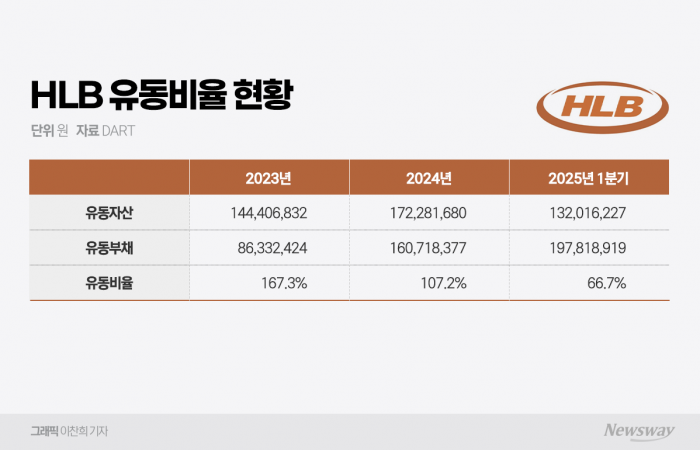
HLB 1분기 유동비율 66.7%, 전년 대비 급락
현금성 자산 930억원→606억원(35% 감소)
유동부채 1607억원→1978억원(23% 증가)
38회차·39회차 CB 각각 570억원, 330억원 규모
FDA, 재심사 절차 클래스 1(2개월)·클래스 2(6개월)로 구분
클래스 2로 분류 시 연내 허가 어려울 수 있음
HLB, 항서제약과 비밀유지계약으로 세부내용 공개 제한
HLB는 "FDA는 보완사항에 이견이 없으며, 이를 기반으로 추가 자료 제출을 요청했다"며 "항서제약은 빠르게 관련 데이터를 확보한 뒤 재신청에 나설 계획"이라고 밝혔다.
다만 재신청 일정과 세부 내용은 아직 공개되지 않았다. HLB 관계자는 "이번 미팅은 항서제약의 제조시설 관련 사안으로, 공지 전 항서와의 협의가 필요하다"며 "세부 내용은 추후 공지할 예정"이라고 전했다.
리보세라닙·캄렐리주맙 병용요법은 지난 3월 FDA로부터 보완요청서(CRL)를 받으며 허가가 보류된 바 있다. 이는 지난해 CRL에 이은 두 번째 반려 조치로 HLB와 항서제약은 현재 세 번째 품목허가 재도전을 준비 중이다.
문제는 시간이 많지 않다는 점이다. HLB의 올해 1분기 유동비율은 66.7%로, 2023년(167.3%)과 비교해 급락했다. 같은 기간 현금성 자산은 930억원에서 606억원으로 35% 감소했고, 유동부채는 1607억원에서 1978억원으로 23% 증가했다.
유동부채 증가는 전환사채가 단기부채로 전환된 영향으로 분석된다. 지난해 말 대비 비유동부채는 약 315억원 감소한 반면, 유동부채는 약 371억원 증가했다. 이는 회계기준상 조기상환청구권(풋옵션)이 1년 이내 도래하면 단기부채로 분류되기 때문이다.
현재 HLB가 보유한 38회차와 39회차 CB는 각각 570억원, 330억원 규모로, 풋옵션 가능 시점은 각각 2025년 9월 9일, 2026년 1월 16일이다. 만기까지는 여유가 있지만 주가가 전환가액을 밑돌며 부진한 흐름을 이어가고 있어 조기상환 가능성이 제기된다.
이에 대해 HLB 관계자는 "38회차 CB의 만기는 2027년 3월로, 1년 이상 남아 있다"며 "간암 신약 외에도 리라푸그라티닙 등 다수의 파이프라인을 보유하고 있어 풋옵션 행사 가능성은 낮다"고 설명했다.
다만, HLB의 높은 PBR(주가순자산비율) 14.06은 신약 가치가 주가에 선반영돼 있음을 의미하며 신약 허가 실패 시 주가 급락 가능성이 크다는 평가도 나온다. 실제로 1차, 2차 CRL 수령 당시 HLB 그룹주는 일제히 하한가를 기록했다.
당장의 관심은 리보세라닙·캄렐리주맙 병용요법의 FDA 재신청 일정이다. 진양곤 HLB 회장은 5월 내 재신청, 7월 승인 목표를 밝혔으나 일정이 지연되고 있다.
FDA는 신약 재심사 접수 후 ▲서류 심사만으로 결정하는 '클래스 1'(2개월 내 결정)과 ▲현장 실사를 포함하는 '클래스 2'(6개월 내 결정)로 분류해 평가한다. 오는 10월까지 재신청이 이뤄지지 않거나 클래스 2로 분류될 경우, 연내 허가가 어려워질 수 있다.
HLB 측은 "FDA 지적사항은 항서제약 제조시설 관련 단일 이슈로 경미한 수준이며, 클래스 1 지정이 기대된다"고 밝혔다. 하지만 클래스 2로 분류될 경우 시장의 의구심이 커질 수 있다.
한편, HLB는 항서제약과 비밀유지계약(NDA)을 맺고 있어 미팅 세부내용을 독자적으로 공개할 수 없다고 밝혔다. 향후 일정은 항서제약이 자체 계획을 마련한 후, 엘레바와 협의해 공지될 예정이다.

뉴스웨이 이병현 기자
bottlee@newsway.co.kr
저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지







댓글